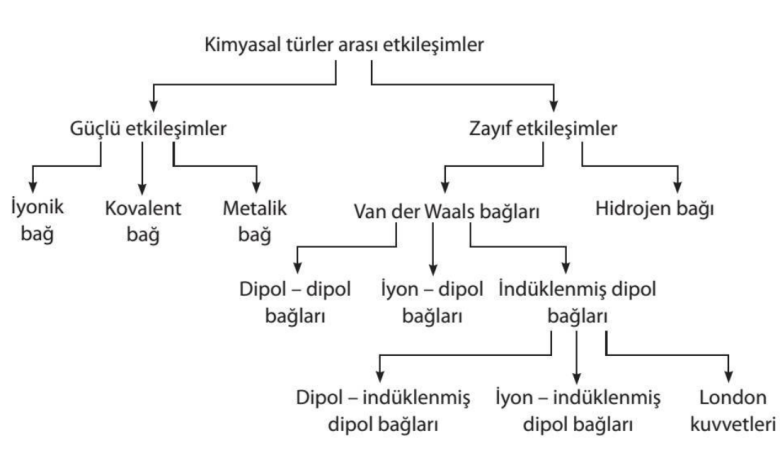
Kimyasal Türler Arası Etkileşimler
Farklı Elementlerin Bir Araya Gelmesiyle Oluşan Güçlü Bağlar
Kimyasal türler arası etkileşimler, kimyanın temel prensiplerinden biridir. Bu etkileşimler, farklı elementlerin ve bileşiklerin bir araya gelerek yeni maddelerin oluşmasını sağlar. Bu süreçte, atomlar arasında elektronların paylaşılması, transfer edilmesi veya elektronik çekirdekler arasında elektrostatik etkileşimler gerçekleşir. Bu etkileşimler, kimyasal bağlar olarak adlandırılır ve maddenin özelliklerini belirleyen temel unsurlardır.
Kimyasal türler arası etkileşimlerin en temel sınıflandırması güçlü yada zayıf olması şeklindedir. Güçlü etkileşimler; iyonik, kovalent ve metalik bağlardır. Zayıf Etkileşimler ise ; Van Der Waals ve Hidrojen bağlarıdır.
Kimyasal Türler Arası Güçlü Etkileşimler
İyonik Bağlar
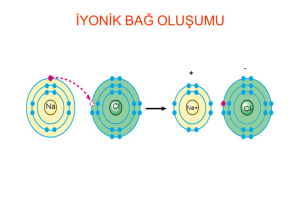
İyonik bağlar, bir metal elementinin pozitif yüklü iyonlarla ve bir ametal elementinin negatif yüklü iyonlarla birleşerek oluşur. Elektron transferi sonucunda, pozitif yüklü iyonlar (katyonlar) ve negatif yüklü iyonlar (anyonlar) arasında elektrostatik çekim gerçekleşir. Örneğin, sodyum klorür (NaCl) bileşiği iyonik bağlarla bir arada tutulan bir kristal yapıya sahiptir.
İyonik bağlar, kimyanın temel yapı taşlarından biridir. İki farklı yüklü iyonun elektrostatik çekim gücüyle oluşan bağlara denir. Bu bağlar, metal ve ametal elementler arasında meydana gelir ve bir elektronun transferiyle oluşur.
İyonik bağlar, bir metal elementin pozitif yüklü iyonlarla ve bir ametal elementin negatif yüklü iyonlarla birleşmesiyle ortaya çıkar. Elektron transferi sonucunda, pozitif yüklü iyonlar (katyonlar) ve negatif yüklü iyonlar (anyonlar) arasında elektrostatik çekim gerçekleşir. Bu çekim, iyonlar arasında güçlü bir bağın oluşmasına neden olur.
İyonik bağlar, iyonların elektronları aktararak daha kararlı hale gelmesini sağlar. Metal elementler genellikle elektron verirken, ametal elementler elektron alır. Örneğin, sodyum (Na) bir elektron vererek Na+ katyonunu oluştururken, klor (Cl) bir elektron alarak Cl- anyonunu oluşturur. Bu iyonlar arasındaki çekim, sodyum klorür (NaCl) bileşik olarak adlandırılan kristal yapıyı oluşturur.
İyonik bağlar, kristal yapıların ve tuzların temelini oluşturur. Bu bağlar, yüksek kaynama noktaları, erime noktaları ve kristal yapıların sertliği gibi özelliklere katkıda bulunur. Ayrıca, iyonik bağlar iyonik bileşiklerin suda çözünürlüğünü etkiler. Suda çözünür olan iyonik bileşikler, suda iyonlara ayrışarak elektriksel iletkenlik gösterirler.
İyonik bağlar, kimya endüstrisinde de önemli bir rol oynar. Birçok bileşiğin üretiminde kullanılır ve bazı bileşiklerin özelliklerini belirler. Örneğin, sodyum klorür (NaCl) tuzunun iyonik bağları, yiyeceklerin tatlandırılmasında ve korunmasında yaygın bir şekilde kullanılır.
İyonik bağlar, ayrıca minerallerin ve kayaçların oluşumunda da önemli bir rol oynar. Mineraller, kristal yapılarında iyonik bağları içeren elementlerin birleşmesiyle oluşur. Bu bağlar, mineralin sertliği, parlaklığı ve diğer fiziksel özelliklerini belirler.
Kovalent Bağlar
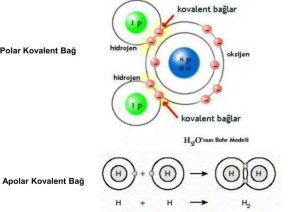
Kovalent bağlar, iki ametal elementinin elektronları paylaşmasıyla oluşur. Elektronlar, atomların dış enerji seviyelerinde bulunan yörüngelerde hareket eder. Atomlar, elektronları paylaşarak dış yörüngelerini tamamlayarak daha kararlı bir yapı elde etmeye çalışır. Kovalent bağlar, moleküler bileşiklerin oluşumunda rol oynar. Örneğin, hidrojen ve oksijen atomları arasında oluşan kovalent bağlar, su (H2O) molekülünün oluşumunu sağlar.
Kovalent bağlar, atomların elektronları paylaşmasıyla oluşan moleküler bağlardır. Bu bağlar, ametal elementler arasında oluşur ve maddenin yapısını ve özelliklerini belirler. Kovalent bağlar, kimyanın temel yapı taşlarından biridir ve birçok bileşiğin oluşmasını sağlar.
Kovalent bağlar, atomların dış enerji seviyelerindeki elektronların birleşmesiyle oluşur. Elektronlar, atomların çekirdekleri etrafında belirli yörüngelerde hareket eder. Atomlar, dış enerji seviyelerindeki eksik veya fazla elektronlarını paylaşarak daha kararlı bir yapı elde etmeye çalışır. Bu elektron paylaşımı, atomlar arasında kovalent bağların oluşmasına yol açar.
Kovalent bağlar, farklı türde iki ametal element arasında veya aynı elementin atomları arasında oluşabilir. Örneğin, hidrojen (H) atomu, bir oksijen (O) atomuyla elektron paylaşarak su (H2O) molekülünü oluşturur. Elektronlar, paylaşım yoluyla atomları bir arada tutar ve molekülün yapısını stabilize eder.
Kovalent bağlar, polar veya apolar olabilir. Polar kovalent bağlar, elektronların paylaşılmasında farklılık gösteren atomlar arasında oluşur. Elektronlar, daha elektronegatif olan atom tarafından daha güçlü bir şekilde çekilir. Bu durumda, elektronlar atomlar arasında biraz asimetrik dağılım gösterir ve molekülde bir dipol momenti oluşur. Örneğin, hidrojen ve oksijen arasındaki bağlar, su molekülünde polar kovalent bağlara örnek olarak verilebilir.
Apolar kovalent bağlar ise elektronların eşit olarak paylaşıldığı durumlarda oluşur. Elektronlar, atomlar arasında eşit bir şekilde dağılır ve molekülde herhangi bir dipol momenti oluşmaz. Bu tür bağlar genellikle aynı elementin atomları arasında veya aynı elektronegatiflik seviyesine sahip atomlar arasında bulunur.
Kovalent bağlar, birçok bileşiğin oluşumunu ve özelliklerini belirler. Organik bileşiklerde, karbon atomları arasındaki kovalent bağlar karmaşık moleküler yapıların oluşmasını sağlar. Örneğin, glukoz gibi karbonhidratlar, kovalent bağlarla birbirine bağlanmış karbon, hidrojen ve oksijen atomlarından oluşur.
Kovalent bağlar ayrıca kimya endüstrisinde de önemli bir rol oynar. Birçok sentetik madde ve ilaç, kovalent bağlar aracılığıyla moleküllerin bir araya gelmesiyle üretilir. Kovalent bağlar, moleküllerin kimyasal reaksiyonlarda birbirine bağlanmasını sağlar ve yeni bileşiklerin oluşumunu mümkün kılar.
Kovalent bağlar ayrıca polimerlerin oluşumunda da kritik bir rol oynar. Polimerler, tekrarlayan yapıya sahip moleküllerin bir araya gelmesiyle oluşan büyük moleküllerdir. Kovalent bağlar, polimer zincirlerinin oluşmasını ve stabil hale gelmesini sağlar. Örneğin, polietilen ve polistiren gibi polimerler, karbon atomlarının kovalent bağlarla birbirine bağlanmasıyla oluşur.
Kovalent bağlar, aynı zamanda biyokimyada da önemli bir rol oynar. Proteinler, nükleik asitler (DNA ve RNA) ve karbonhidratlar gibi biyomoleküller, kovalent bağlarla birbirine bağlı atomların düzenlenmesiyle oluşur. Bu bağlar, biyolojik fonksiyonların gerçekleştirilmesi için hayati öneme sahiptir.
Metalik Bağlar
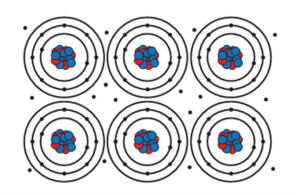
Metalik bağlar, metallerin içinde bulunduğu yapıya özgüdür. Metallerde, atomlar arasında dış elektronların serbestçe hareket etmesi ve metalik bir deniz oluşturması sonucu metalik bağlar oluşur. Bu bağlar, metallerin termal ve elektriksel iletkenlik gibi özelliklerini açıklar. Örneğin, bakır atomlarının metalik bağlarla birleşmesi sonucu bakır metalinin oluştuğunu söyleyebiliriz.
Metalik bağlar, metallerin içinde bulunduğu yapıya özgü olan kuvvetli bağlardır. Bu bağlar, metal atomlarının serbest elektronlarla etkileşimine dayanır. Metalik bağlar, metallerin birçok özelliğini ve davranışını açıklar.
Metalik bağlar, metal atomlarının dış enerji seviyelerindeki elektronların serbestçe hareket etmesiyle oluşur. Metal atomları, dış enerji seviyelerindeki elektronlarından birkaçını kolayca kaybedebilir, bu da metal atomlarının pozitif yüklü iyonlar haline gelmesine neden olur. Serbest kalan bu elektronlar, metal içinde serbestçe hareket eder ve metalik bağı oluşturur.
Metalik bağlar, metal atomlarının pozitif iyonları ve serbest elektron denizi arasında elektrostatik çekim ile gerçekleşir. Pozitif iyonlar, serbest elektron denizinde bulunan negatif yüklü serbest elektronlar tarafından çekilir ve tutulur. Bu çekim kuvveti, metalik bağların gücünü ve dayanıklılığını belirler.
Metalik bağlar, metallerin birçok özelliğini açıklar. Metaller genellikle yüksek elektriksel ve termal iletkenlik gösterir. Bu, serbest elektronların kolayca hareket etmesiyle açıklanır. Metalik bağlar ayrıca metallerin yüksek erime ve kaynama noktalarına sahip olmasını da sağlar. Metalik bağlar, metal kristal yapılarının sertliği ve dayanıklılığı için de sorumludur.
Metalik bağlar, metallerin plastiğiği (yani şekil değiştirme yeteneği) ve dövülebilirliği gibi özelliklerini de belirler. Serbest elektronlar, metalin kristal yapısında kolayca hareket edebilir, böylece metallerin dış kuvvetlere karşı esnekliği artar. Bu, metallerin tel ve levhalar halinde dövülmesi ve şekillendirilmesi için önemlidir.
Metalik bağlar, alaşım oluşumunu da açıklar. Alaşımlar, iki veya daha fazla metalin birleşmesiyle oluşan malzemelerdir. Metalik bağlar, farklı metal atomlarının bir araya gelerek homojen bir yapı oluşturmasını sağlar. Bu da alaşımların farklı özelliklere sahip olmasını ve kullanım alanlarının çeşitliliğini sağlar.
Kimyasal türler arası etkileşimler, maddenin özelliklerini belirler. Bu etkileşimler, moleküler yapıların ve bileşiklerin oluşumunu mümkün kılar. Kimyasal reaksiyonlar da bu etkileşimler üzerine kuruludur. Kimyasal türler arası etkileşimler, maddenin fiziksel ve kimyasal özelliklerini belirler. Örneğin, moleküler yapıdaki kovalent bağlar, molekülün geometrisini ve bileşiklerin özelliklerini belirler. İyonik bağlar, kristal yapıların oluşmasına ve sertlik gibi özelliklere katkıda bulunur. Metalik bağlar ise metallerin yüksek iletkenlik ve yumuşaklık gibi karakteristik özelliklerini açıklar.
Kimyasal türler arası etkileşimler aynı zamanda kimyasal tepkimelerin temelini oluşturur. Tepkimelerde, kimyasal bağlar kırılır ve yeni bağlar oluşur. Bu süreçte, atomlar arasındaki elektron transferi, paylaşımı veya elektrostatik etkileşimler gerçekleşir. Bu kimyasal reaksiyonlar, elementlerin farklı bileşiklere dönüşmesini sağlar.
Kimyasal türler arası etkileşimlerin anlaşılması, kimyanın birçok alanında önemlidir. Organik kimyada, kovalent bağlar aracılığıyla karbon atomlarının birleşmesiyle kompleks moleküller oluşur. İnorganik kimyada ise iyonik bağlar, metal komplekslerinin oluşmasını ve farklı bileşiklerin reaksiyonlarını açıklar. Fiziksel kimyada ise kimyasal türler arası etkileşimler, enerji değişimlerini ve reaksiyon hızlarını etkiler.
Kimyasal türler arası etkileşimler, modern teknolojilerin temelinde de yer alır. Kimyasal bağlar sayesinde ilaçlar, polimerler, elektronik bileşenler ve enerji depolama sistemleri gibi birçok önemli malzeme ve teknoloji geliştirilir. Bu nedenle, kimyasal türler arası etkileşimlerin anlaşılması ve kontrol edilmesi, ilerlemeye yönelik araştırmaların ve yeniliklerin temelini oluşturur.
Kimyasal türler arası etkileşimler, farklı elementlerin bir araya gelerek yeni maddelerin oluşmasını sağlayan güçlü bağlardır. İyonik, kovalent ve metalik bağlar gibi farklı tipleri vardır ve maddenin özelliklerini belirler. Bu etkileşimler, kimyanın temel prensiplerinden biridir ve kimya biliminin birçok alanında önemli bir rol oynar. Ayrıca, teknolojik ilerlemenin temelini oluşturarak birçok farklı uygulama alanında kullanılır.
Kimyasal Türler Arası Zayıf Etkileşimler
Van Der Waals Bağları
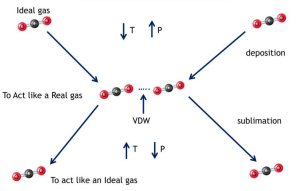
Van der Waals bağı, moleküller arasında zayıf kuvvetlerin etkileşimi olarak tanımlanan bir kimyasal bağ türüdür. Bu bağ, moleküllerin elektriksel özelliklerinden kaynaklanan geçici dipol momentlerinin birbirleriyle etkileşimi sonucunda oluşur. Van der Waals bağı, moleküllerin geçici dipol-dipol, dipol-zayıf dipol veya dipol-indüklenmiş dipol etkileşimleriyle birbirine bağlanmasını sağlar.
Van der Waals bağı, moleküller arasında elektronların dağılımı nedeniyle oluşan kısa süreli dipol momentlerine dayanır. Elektronların konumu ve hareketi, bir molekülün geçici olarak polar olmasına neden olabilir. Bu polarizasyon, molekülün etrafındaki diğer moleküllerle geçici dipol-dipol etkileşimlerine yol açar. Bu etkileşimler, moleküller arasında çekici bir kuvvetin ortaya çıkmasına neden olur.
Van der Waals bağı ayrıca dipol-zayıf dipol etkileşimlerini de içerir. Bu etkileşimler, bir molekülde kalıcı bir dipol momentine sahip olmayan, ancak geçici polarizasyon yaşayabilen moleküller arasında gerçekleşir. Bu tip etkileşimler, polar olmayan gaz moleküllerinin, birbirlerine yakın olduklarında geçici dipol momentlerinin ortaya çıkmasına ve dolayısıyla çekici bir etkileşim oluşturmasına dayanır.
Bununla birlikte, Van der Waals bağı, dipol-indüklenmiş dipol etkileşimleri olarak da adlandırılan bir başka etkileşimi içerir. Bu etkileşimler, bir molekülün elektriksel olarak polar olması nedeniyle, çevredeki diğer moleküllerde geçici bir dipol momenti oluşturur. Bu geçici dipol momenti, polar olmayan bir molekülün etkilenerek çekici bir etkileşim oluşturmasına neden olur.
Van der Waals bağı, moleküllerin termal enerji ile hareket ettiği durumda ortaya çıkan zayıf kuvvetlerdir. Bu bağlar, moleküller arasındaki çekici kuvvetlerin yanı sıra moleküllerin birbirlerine yaklaşmasını sınırlayan itici kuvvetlerin de etkisi altındadır. Van der Waals bağı, genellikle gaz molekülleri arasında etkilidir, ancak sıvı ve katı haldeki maddelerde de rol oynayabilir.
Van der Waals bağı, kimya, fizik, malzeme bilimi ve biyoloji gibi çeşitli bilim alanlarında önemli bir rol oynar. Özellikle, moleküler yapının stabilitesi, moleküller arasındaki Van der Waals bağlarına bağlıdır. Bu bağlar, moleküllerin bir arada kalmasını sağlar ve maddenin fiziksel ve kimyasal özelliklerini belirler.
Van der Waals bağı, kimya endüstrisinde de önemli bir rol oynar. Birçok molekül, kimyasal reaksiyonlarda birleştiğinde veya maddelerin fiziksel durumları değiştiğinde Van der Waals bağlarına bağlı olarak düzenlenir. Ayrıca, bu bağlar, moleküllerin birbirlerine adsorbe olmasını sağlar ve bu da kataliz ve ayrışma gibi önemli süreçlerin gerçekleşmesinde etkilidir.
Biyolojide, proteinlerin ve DNA’nın yapısında da Van der Waals bağları önemli bir rol oynar. Proteinlerin katlanması ve stabilize olması, moleküller arasındaki bu bağların etkisiyle gerçekleşir. Ayrıca, proteinlerin substratlara bağlanması ve enzimatik reaksiyonlarda etkili olmaları da Van der Waals bağlarına dayanır. DNA molekülünde de baz çiftleri arasındaki bağlar, Van der Waals kuvvetleri tarafından stabilize edilir.
Van der Waals bağları, nanoteknoloji ve malzeme bilimi gibi ileri teknolojik alanlarda da önemli bir rol oynamaktadır. Nanomalzemelerin ve nanotüplerin yapısında ve düzenlenmesinde Van der Waals bağları etkilidir. Ayrıca, nanomateryallerin yüzey özelliklerini ve etkileşimlerini anlamak ve kontrol etmek için bu bağlar üzerinde çalışmalar yapılmaktadır.
Van der Waals bağı, moleküller arasındaki zayıf kuvvetlerin etkileşimine dayanan bir kimyasal bağ türüdür. Bu bağlar, gazlardan katılara kadar farklı maddelerin yapısını ve özelliklerini belirler. Kimya, fizik, malzeme bilimi ve biyoloji gibi birçok bilim alanında önemli bir rol oynar. Van der Waals bağlarının anlaşılması, yeni malzemelerin tasarlanması, biyolojik sistemlerin çalışması ve teknolojik ilerlemenin sağlanması açısından büyük öneme sahiptir.
Hidrojen Bağları
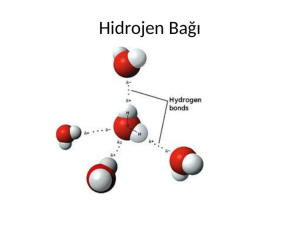
Hidrojen bağları, moleküller arasında oluşan zayıf ve özgün bir tür bağdır. Bu bağlar, hidrojen atomunun bir elektron çiftiyle bağlı olduğu bir elektronegatif atom arasında oluşur. Hidrojen bağları, suyun özelliklerinin yanı sıra birçok biyolojik ve kimyasal sistemde de önemli bir rol oynar.
Hidrojen bağları, hidrojen atomunun bir elektronegatif atomla (genellikle oksijen, azot veya flor) bağ yapmasıyla oluşur. Elektronegatif atom, elektronları daha güçlü bir şekilde çeker ve hidrojen atomunun pozitif yükü ile negatif yük arasında çekici bir kuvvet yaratır. Bu etkileşim, hidrojen bağının oluşmasına neden olan güçlü bir elektrostatik etkileşimdir.
Hidrojen bağları, diğer bağ türlerine göre daha zayıf olsa da, birçok önemli özelliği etkiler. Örneğin, su molekülünde hidrojen bağları, suyun yüksek kaynama noktası, erime noktası ve yoğunluğunu açıklar. Hidrojen bağları ayrıca, suyun yüzey gerilimi ve kapillar etkisi gibi özelliklerinin oluşmasında da rol oynar.
Hidrojen bağları biyolojik sistemlerde de önemli bir role sahiptir. DNA molekülünde, baz çiftleri arasında hidrojen bağları bulunur ve bu bağlar, DNA’nın yapısının stabilitesini sağlar. Proteinlerin yapısında da hidrojen bağları, protein katlanmasında ve stabilize olmasında kritik bir rol oynar.
Hidrojen bağları ayrıca kimya ve kimya endüstrisinde de önemli bir rol oynar. Reaksiyon hızını etkileyebilir ve moleküller arasındaki etkileşimleri düzenleyebilir. Hidrojen bağları, moleküler tanıma, kataliz ve moleküler organizasyon gibi birçok kimyasal sürecin temelini oluşturur.
Hidrojen bağları, kimya biliminde ve uygulamalarında büyük bir ilgi çeken konudur. Bilim insanları, hidrojen bağlarını daha iyi anlamak, kontrol etmek ve manipüle etmek için çalışmalar yapmaktadır. Bu çalışmalar, yeni malzemelerin tasarlanması, ilaç geliştirme, kataliz ve enerji depolama gibi alanlarda önemli ilerlemeler sağlamaktadır.
Hidrojen bağları, moleküller arasında güçlü ve özgün bir bağ türüdür. Hidrojen atomunun elektronegatif atomlarla oluşturduğu bu etkileşimler, suyun özelliklerinden biyolojik sistemlere kadar geniş bir yelpazede önemli bir rol oynar. Su molekülündeki hidrojen bağları, suyun benzersiz özelliklerini ve yaşamın sürdürülmesi için kritik olan özelliklerini açıklar.
Hidrojen bağlarının bir diğer önemli örneği, proteinlerin ve enzimlerin yapısında bulunur. Proteinler, karmaşık ve üç boyutlu yapılarıyla biyolojik işlevleri yerine getirir. Hidrojen bağları, proteinin katlanmasında ve stabilize olmasında kritik bir rol oynar. Proteinlerin fonksiyonları, hidrojen bağlarının korunması ve uygun bir şekilde düzenlenmesiyle ilişkilidir.
Hidrojen bağları, ayrıca DNA molekülünde de bulunur. DNA, genetik bilginin depolandığı ve aktarıldığı moleküler bir yapıdır. DNA’daki baz çiftleri arasındaki hidrojen bağları, çift sarmalın stabilitesini sağlar. Bu, DNA’nın kopyalanması ve genetik bilginin aktarılması için hayati bir öneme sahiptir.
Hidrojen bağları, kimya endüstrisinde de önemli bir role sahiptir. Moleküller arasındaki hidrojen bağları, reaksiyon kinetiğini etkileyebilir ve kimyasal tepkimelerin seçiciliğini belirleyebilir. Ayrıca, hidrojen bağları moleküler tanıma, kataliz ve moleküler organizasyon gibi birçok kimyasal sürecin temelini oluşturur.
Son yıllarda, hidrojen bağlarının anlaşılması ve kontrol edilmesi konusunda büyük ilerlemeler kaydedilmiştir. Bilim insanları, hidrojen bağlarına dayalı yeni malzemelerin tasarlanması, ilaç geliştirme, enerji depolama ve moleküler tanı gibi alanlarda çalışmaktadır. Hidrojen bağları, genellikle istenmeyen etkileşimlerin engellenmesi veya istenen etkileşimlerin yönlendirilmesi yoluyla daha karmaşık sistemlerin tasarlanmasına olanak tanır.
Hidrojen bağları moleküller arasında güçlü ve özgün bir etkileşim sağlar. Bu bağlar, suyun benzersiz özelliklerinden biyolojik sistemlere kadar birçok alanda önemli bir rol oynar. Hidrojen bağları, kimya biliminde ve uygulamalarında büyük bir ilgi çeken konudur ve gelecekte daha fazla keşif ve inovasyon için potansiyel sunmaktadır.




Bir Yorum